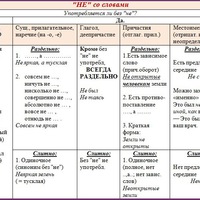
Помогите пожалуйста 45 баллов!!! Решите с дано, подробным решением Определите массу
осадка,который образуется при сливании 10 г 5% раствора хлорида натрия и 5 г 10% раствора сульфата серебра. 0
0
 0
0
Ответы на вопрос
 Внимание! Ответы на вопросы дают живые люди. Они могут содержать ошибочную информацию, заблуждения, а также ответы могут быть сгенерированы нейросетями. Будьте внимательны. Если вы уверены, что ответ неверный, нажмите кнопку "Пожаловаться" под ответом.
Внимание! Ответы на вопросы дают живые люди. Они могут содержать ошибочную информацию, заблуждения, а также ответы могут быть сгенерированы нейросетями. Будьте внимательны. Если вы уверены, что ответ неверный, нажмите кнопку "Пожаловаться" под ответом.

Дано:
10г 5% раствора NaCl
5г 10% раствора Аg2SO4
Найти: m(AgCl) -?
Решение:
Сначала необходимо найти массы и количество вещества реагентов.Для этого необходимо -->
m(вещества)= m(раствора) × w(массовая доля)/100%
n(количество вещества) = m(x)/ Mr(x)
m(NaCl)= 10 × 5%/100%= 0.5 г
n(NaCl)= 0.5г/58,5= 0.008547
m(Ag2SO4)= 5× 10%/100%=0.5г
n(Ag2SO4)= 0.5г/ 312=0.0016
Исходя из количества реанентов можно понять что NaCl находиться в избытке. Если сократить реакцию до Ag2SO4 = 2AgCl то видно что сальфат серебра соотноситься с хлоридом как 1:2, а значит n(AgCl)=0.0016×2=0.0032
Теперь можно находить массу AgCl. m(AgCl)= 0.0032×143.5=0.4592
Ответ: масса АgCl(осадок) равна 0.4592г
 0
0
 0
0

Хорошо, давайте решим эту задачу по шагам.
Для начала определим, сколько вещества содержится в каждом из растворов.
- Раствор хлорида натрия (NaCl):
- Масса раствора = 10 г
- Концентрация раствора = 5% (т.е. 5 г NaCl на 100 г раствора)
Для расчета массы NaCl в растворе умножим массу раствора на концентрацию: Масса NaCl = 10 г * 0.05 = 0.5 г
- Раствор сульфата серебра (Ag2SO4):
- Масса раствора = 5 г
- Концентрация раствора = 10% (т.е. 10 г Ag2SO4 на 100 г раствора)
Для расчета массы Ag2SO4 в растворе умножим массу раствора на концентрацию: Масса Ag2SO4 = 5 г * 0.10 = 0.5 г
Теперь, когда у нас есть массы NaCl и Ag2SO4 в растворах, нужно определить, какое количество из этих веществ отреагирует между собой.
Уравнение реакции между NaCl и Ag2SO4 выглядит следующим образом: 2NaCl + Ag2SO4 -> 2AgCl + Na2SO4
Из уравнения видно, что 2 молекулы NaCl реагируют с 1 молекулой Ag2SO4, образуя 2 молекулы AgCl и 1 молекулу Na2SO4.
Теперь вычислим мольные массы соответствующих веществ:
- NaCl: мольная масса Na = 22.99 г/моль, мольная масса Cl = 35.45 г/моль Мольная масса NaCl = 22.99 + 35.45 = 58.44 г/моль
- Ag2SO4: мольная масса Ag = 107.87 г/моль, мольная масса S = 32.06 г/моль, мольная масса O = 16.00 г/моль Мольная масса Ag2SO4 = 2 * 107.87 + 32.06 + 4 * 16.00 = 303.29 г/моль
Теперь посчитаем количество вещества каждого реагента:
- Моль NaCl = масса NaCl / мольная масса NaCl = 0.5 г / 58.44 г/моль ≈ 0.00856 моль
- Моль Ag2SO4 = масса Ag2SO4 / мольная масса Ag2SO4 = 0.5 г / 303.29 г/моль ≈ 0.00165 моль
Теперь рассмотрим соотношение между NaCl и Ag2SO4 в уравнении реакции: 2:1. Молей Ag2SO4 меньше, поэтому он ограничит ход реакции.
Теперь найдем количество AgCl, образующегося в реакции:
- Моль AgCl = 2 * моль Ag2SO4 = 2 * 0.00165 моль ≈ 0.0033 моль
Наконец, найдем массу AgCl:
- Масса AgCl = моль AgCl * мольная масса AgCl = 0.0033 моль * 143.32 г/моль ≈ 0.473 г
Таким образом, масса осадка (AgCl), который образуется при сливании этих двух растворов, составляет приблизительно 0.473 г.
 0
0
 0
0
Похожие вопросы
Топ вопросов за вчера в категории Химия
Последние заданные вопросы в категории Химия
-
Математика
-
Литература
-
Алгебра
-
Русский язык
-
Геометрия
-
Английский язык
-
Химия
-
Физика
-
Биология
-
Другие предметы
-
История
-
Обществознание
-
Окружающий мир
-
География
-
Українська мова
-
Информатика
-
Українська література
-
Қазақ тiлi
-
Экономика
-
Музыка
-
Право
-
Беларуская мова
-
Французский язык
-
Немецкий язык
-
МХК
-
ОБЖ
-
Психология
-
Физкультура и спорт
-
Астрономия
-
Кыргыз тили
-
Оʻzbek tili


























